L'hémagglutinine, la neuraminidase et l'acide sialique
L'hémagglutinine
L'hémaglutinine est une protéine antigénique trouvée à la surface des virus Inflenza type A. Elle est synthétisée sous forme d'un précurseur inactif HA0 par le virus.
La structure tridimensionnelle de l'hémagglutine révèle qu'il s'agit d'un homotrimère (molécule formée de trois monomères identiques). Chaque monomère est une glycoprotéine HA0 constituée de deux sous-unités:
- la partie extracellulaire globulaire ou HA1 présente le site de liaison, appelé site RBS, au récepteur des cellules cibles comportant une molécule d'acide sialique
- la partie formant une tige ou HA2 permet la fusion de la membrane phospholipidique qui recouvre la particule virale avec la membrane de l'endosome de la cellule hôte lors du processus d'assemblage et de libération des virions (voir le cycle du virus). Cette partie HA2 présente
- un domaine transmembranaire hydrophobe
- un domaine ou "une queue" intracellulaire
Une fois attachée à la surface de la cellule hôte, pour être fonctionnelle et permettre l'infection, les parties de l'hémagglutinine HA1 et HA2 doivent être séparées l'une de l'autre grâce à un clivage au niveau d'un peptide reliant les deux sous-unités. Tant que la coupure n'a pas eu lieu les virus ne sont pas capables d'infecter une cellule.
Dans le cas des virus H5N1 ce clivage est réalisé par une protéase sur un site précis assez étroit dit "site de clivage" ou "site de segmentation". Selon la pathogénicité des souches virales c'est à dire souche dite faiblement pathogène IAFP (Influenza A faiblement pathogène) ou souche dite hautement pathogène IAHP le site de clivage de l'hémaglutinine sera différent.
Les souches H5N1 IAFP présentent au niveau du site de clivage de HA0 un ou deux résidus basiques: l'arginine (R) qui sera la cible de protéases type trypsine présentes esentiellement au niveau des tissus respiratoires chez l'homme et respiratoires et/ou digestifs chez l'oiseau. Ces protéases ne sont pas toujours présentes dans les autres tissus de l'organisme ce qui limite naturellement la diffusion des virus.
Les souches H5N1 IAHP présentent un site de clivage de HA0 allongé et enrichi en acides aminés basiques, cette séquence multibasique (type RERRRKKR) entraîne une modification de l'organisation de ce site de clivage dans l'espace. Cette modification permet une meilleure accessibilité du site de clivage pour toutes sortes de protéases intracellulaires exprimées dans la plupart des tissus. Ce site multibasique va conduire à une infection et une réplication du virus dans des tissus normalement non permissifs c'est à dire en dehors des voies respiratoires. Pour certaines formes hautement pathogènes le clivage ne nécessite même plus d'enzyme et peut se réaliser spontanément au cours de la maturation de l'hémagglutinine dans l'appareil de Golgi de la cellule hôte.
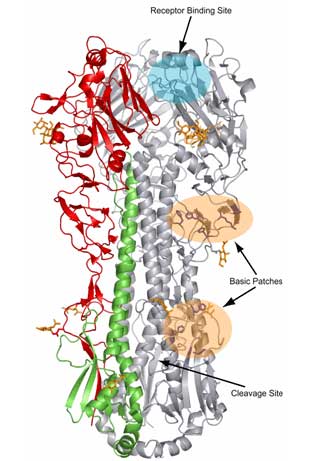 |
Structures 3D de l'hémaglutinine du virus Influenza |
L'hémagglutinine est la cible majeure des anticorps produits par le système immunitaire lors d'un premier contact avec l'agent infectieux.
La neuraminidase
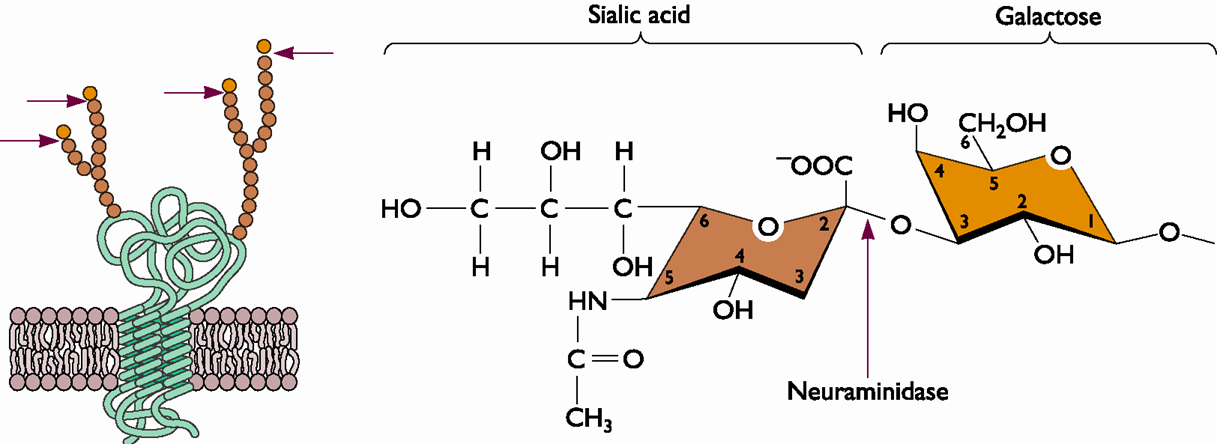
Il s'agit d'une enzyme apparentée à la famille des glycosidases ( dont l'amylase salivaire humaine). Cette enzyme rompt la liaison entre l'acide sialique et l'hémagglutinine, elle détruit ainsi le récepteur cellulaire de l'HA. Cette coupure est indispensable :
- lors de la sortie des virions , ils restent attachés à la cellule hôte au niveau de l'acide sialique, la neuraminidase permet de les détacher (voir l'animation)
- lors de leur sortie les nouveaux virions se recouvrent de la membrane de cellule hôte, ils possèdent à leur surface des acides sialiques ce qui les rend agrégables entre eux, la neuraminidase permet de les séparer
- le mucus de l'épithélium respiratoire est riche en acide sialique et présente un leurre pour les molécules HA, les neuraminidases permettent de les en détacher.
L'acide sialique
Encore nommé acide N-acétylneuraminique, il est associé à une chaine glucidique présente à la surface de la membrane cellulaire et il est présent dans les sécrétions glandulaires (de mucus du tractus respiratoire notamment). L'acide sialique est le substrat de la neuraminidase (voir l'animation).
Il peut être lié au galactose de la chaine glucidique par deux liaisons, une liaison dite alpha 2,3 ou une liaison alpha 2,6. Il représente le récepteur pour l'hémagglutinine des virus Influenza.
| Attachement de l'hémagglutinine au récepteur cellulaire selon deux spécificités: |
|
| D'après E. Nicand HIA du Val de Grâce |
>> Aller vers Les traitements antiviraux (utilisant un analogue de l'acide sialique)